Je potvrzen vliv mikrobiomu na imunitní sytém a konsekventně i genezi onkologických onemocnění. Snahou je docílit optimální strategie modulace střevního mikrobiomu za účelem zvýšení léčebných odpovědí na imunoterapii onkologických onemocnění.
Lidé se vyvinuli společně s koloniemi virů, bakterií, hub a parazitů, které osidlují mukózní povrchy, zejména gastrointestinální trakt, a jsou souhrnně označované jako mikrobiota. U savců mikrobiota ovlivňují mnoho fyziologických procesů (včetně vývoje, metabolismu a imunitních funkcí) a specifické změny ve složení mikrobioty jsou asociovány s náchylností k různým chorobám, včetně obezity, astmatu či zánětlivých onemocnění střev. Celkem ve střevě žije asi 500 druhů mikroorganismů. Dominantními mikroorganismy jsou v tlustém střevě bakterie, které ve výsledku tvoří až 60 % z celkové hmotnosti stolice. V lidských střevech žije tedy přibližně 1013–1014 bakterií, přičemž vlastních buněk lidského těla je asi 1013. Jinými slovy, bakterií v lidském těle je stejně či až desetkrát více než lidských buněk samotných. V roce 2008 National Institutes of Health zahájil Humane Microbiome Project s cílem identifikovat co nejvíce mikroorganismů, které obývají lidské tělo. Odhaduje se, že v našem těle žije kolem 100 bilionů mikroorganismů a jejich celkový genom tvoří 3,3 milionů genů, což je asi 150krát více, než obsahuje lidský genom. Tato čísla úvodem nám mají demonstrovat, s jak rozsáhlým přírodním systémem je naše tělo v permanentní komunikaci na všech úrovních fyziologických pochodů. Složení střevního mikrobiomu není stálé a jedná se o velmi dynamický systém, jehož charakter ovlivňuje řada parametrů. Mikrobiom se mění s věkem, kdy ve stáří se zvyšuje zastoupení bakterií kmene Bacteroidetes, ale celková druhá rozmanitost spíše klesá, zejména je nižší podíl bakterií rodu Bifidobacterium, Clostridium IV a kmene Firmicutes. Vliv na charakter střevní mikroflóry má přirozeně i strava. Výživa bohatá na ovoce, zeleninu a vlákninu vede k větší mikrobiální rozmanitosti. U takových jedinců byl zaznamenán větší počet bakterií metabolizujících rostlinné polysacharidy z kmene Firmicutes. Dalšími faktory ovlivňujícími složení fekálního mikrobiomu jsou geografický výskyt, působení stresu či užívání léků (probiotika, antibiotika).
Mikrobiom a protinádorová imunoterapie
Existují důkazy o vztahu mikrobiomu s výskytem nádorových onemocnění. U některých nádorů byly pozorovány změny ve složení lokální mikrobioty a výskyt konkrétních bakterií, jako jsou Helicobacter pylori, Fusobacterium nucleatum, Salmonella typhi, virus Epsteina-Barrové a lidský papiloma virus. Přítomnost a působení těchto patogenů bylo následně spojené přímo s kancerogenním procesem a dnes jsou již uznávány jako rizikové faktory pro vznik některých nádorových onemocnění. Kromě své úlohy při karcinogenezi je střevní mikrobiota rovněž spojována s efektivitou a toxicitou moderní protinádorové imunoterapie. Jedná se o poměrně novou skupinu léčiv, která má schopnost prolongovat a zefektivnit protinádorovou buněčnou imunitní odpověď. Děje se tak na základě zablokování negativních signálů, kterými organismus přirozeně vypíná imunitní reakci, aby nedošlo k přehnané imunitní odpovědi a poškození vlastních tkání imunitním systémem, tzv. autoimunitnímu zánětu. To vědcům otevírá možnost prozkoumat úmyslné využití mikrobiomu při zlepšování efektivity terapie nádorových onemocnění. Přestože checkpoint inhibitory byly velkým pokrokem v léčbě určitých typů maligních onemocnění, pouze omezená část pacientů reaguje na terapii uspokojivě. Mnoho vědců si uvědomilo, že střevní mikrobiom může hrát důležitou roli při modulaci účinnosti imunoterapie. Dospělo se i k závěrům, že efektivita imunoterapie může být snížena podáváním antibiotik, která snižují biodiverzitu střevní mikroflóry. Dalším velmi důležitým poznáním bylo, že vyšší efektivita imunoterapie je pozorována za přítomnosti specifických střevních mikrobů. Bylo například prokázáno, že komenzální bifidobakterie podporují protinádorovou, buněčnou imunitní odpověď a potencují účinnost anti-PD-L1 terapie. Perorální podání samotných bifidobakterií zlepšilo kontrolu nádorového růstu ve stejné míře jako PD-L1 – blokáda a kombinovaná terapie růst nádoru téměř zastavila.
Dohled nad nádorem či únik jeho buněk
Dvě studie publikované v časopisu Science v listopadu 2017 podporují předchozí zjištění a data z experimentálních myších modelů. Poprvé byly publikované důkazy, že léčebná odpověď na imunoterapii checkpoint inhibitorem (protilátka blokující inhibiční signální molekuly) závisí na složení střevního mikrobiomu. Obě studie z roku 2017 sledovaly odpověď onkologických pacientů na imunoterapii checkpoint inhibitory, což je typ imunoterapie, který blokuje schopnost nádorových buněk vypnout buněčnou, protinádorovou aktivitu T lymfocytů. Výsledná data těchto studií nám ukázala, že respondenti a nereagující mají velmi odlišné složení a funkční vlastnosti svých střevních mikrobiomů. Objevily se specifické typy bakterií, které se zdají být prospěšné pro účinnost imunoterapie checkpoint inhibitorem. Pacienti s lepší léčebnou odpovědí měli ve svém mikrobiomu vyšší výskyt těchto bakterií: Akkermansia munciniphila, Faecalibacterium a dalších specifických komenzálů.
Autoři obou studií prokázali kauzální úlohy mikrobiomu transplantací stolice od lidských pacientů podstupujících imunoterapii do bezmikrobních myší. Výsledky byly jednoznačné. V obou studiích měly myši, které dostávaly střevní mikrobiotu od nereagujících pacientů, horší léčebné výsledky při terapii checkpoint inhibitorem než myši kolonizované výkaly od respondérů. Fekální mikrobiom u respondérů měl signifikantně vyšší biodiverzitu a vyšší výskyt bakterií Ruminococcaceae.
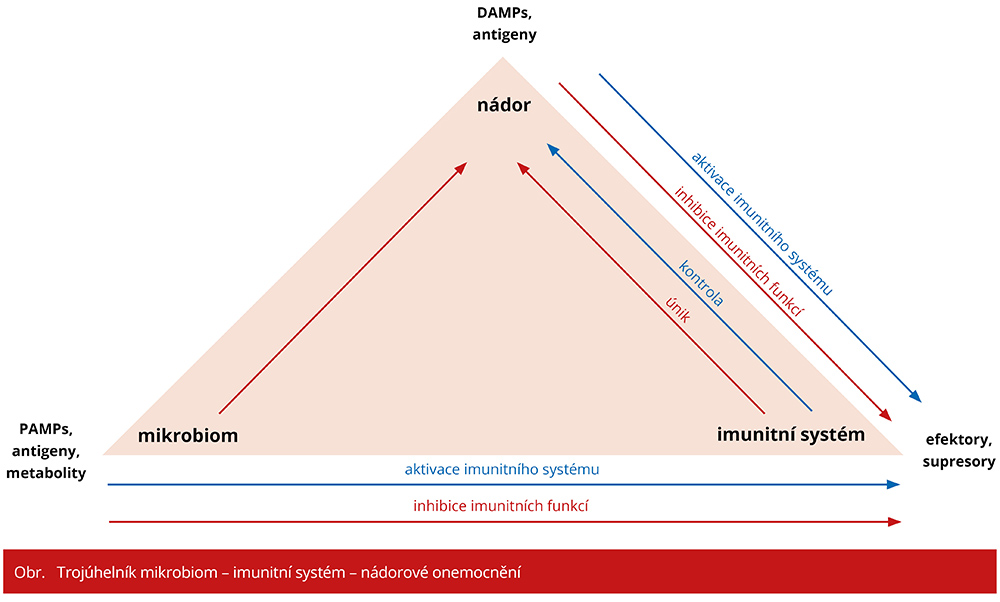
Imunologické profilování pacientů a myší naznačovalo, že příznivý mikrobiom respondérů zvyšuje systémovou a protinádorovou imunitní odpověď, zatímco mikrobiota nereagujících způsobují, že hostitel má alterovanou protinádorovou, buněčnou imunitní odpověď. Tyto zajímavé studie prokazují nejen silnou korelaci mezi složením mikrobiomu a efektivitou imunoterapie, ale také ukazují nové možnosti využití mikrobiomu ke zlepšení účinnosti imunoterapie. Jaké je patofyziologické vysvětlení pro propojení střevní mikroflóry, imunitní buněčné odpovědi a kancerogeneze? Existují takzvané molekuly spojené s ohrožením organismu, DAMPs (danger-associated molecular patterns) a nádorové antigeny, které mohou aktivovat buněčnou imunitní protinádorovou odpověď, zatímco cytokiny a chemokiny přítomné v nádorovém mikroprostředí mohou indukovat nebo přitahovat imunosupresivní imunitní populace. Equilibrium mezi těmito fenomény má vliv na klinický vývoj nádorového onemocnění. Imunitní systém hostitele může být ovšem modulován i patogeny vyskytujícími se ve střevním mikrobiomu, tzv. PAMPs (pathogen-associated molecular patterns), stejně tak jako antigeny a metabolity, které ovlivňují jednak efektory, jednak supresory imunitní reakce. Mikrobiom může tedy ovlivnit jak imunitní dohled nad nádorovým onemocněním, tak únik nádorových buněk z imunitního dozoru.
Fekální mikrobiální transplantace
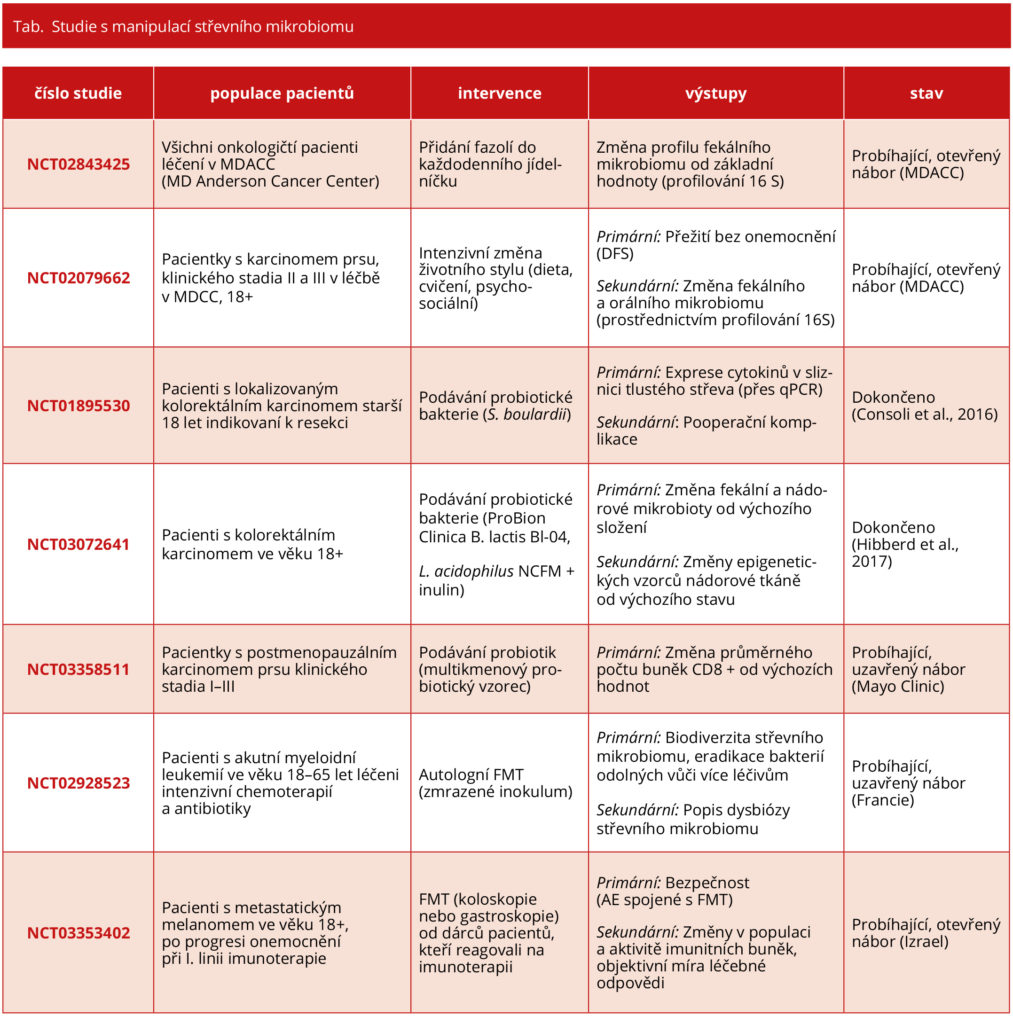
Fekální mikrobiální transplantace (FMT) představuje nejpřímější způsob manipulace se střevní mikrobiotou. FMT může být podávána pacientům orálně formou kapslí nebo přímo aplikována při koloskopii či gastroskopii. FMT se již běžně používá v jiných indikacích, což lze demonstrovat na významném úspěchu při léčbě infekce Clostridium difficile rezistentním na konvenční terapii. Klinické studie využívající FMT u pacientů s nádorovým onemocněním jsou v plenkách, ale na základě výsledků preklinických studií diskutovaných výše vyvolaly velké vzrušení.
Autologní FMT u pacientů s akutní myeloidní leukemií (AML) se zkouší při intenzivní chemoterapii s cílem zabránit dysbióze a zvýšit biodiverzitu střevní mikroflóry v průběhu terapie (NCT02928523). Kromě toho je FMT experimentálně zkoušena u pacientů podstupujících imunoterapii pro zhoubné solidní nádory, zejména u těch, kteří jsou léčeni checkpoint inhibitory (viz tabulka). Stále probíhá studie fáze I u pacientů s metastatickým melanomem, u nichž selhala předchozí imunoterapie (NCT03353402), přičemž refrakterním pacientům je podávána FMT od pacientů s dobrou léčebnou odpovědí na imunoterapii. Primární výsledky zahrnují bezpečnost a schopnost kolonizovat střevní sliznici akceptora, zatímco sekundární výsledky zahrnují změny v periferním imunogramu, změny aktivity jednotlivých imunitních buněk a objektivní léčebnou odpověď na imunoterapii. V současné době probíhá návrh dalších studií, aby se otestovala hypotéza, že modulace střevní mikrobioty zlepší odpověď na imunoterapii checkpoint inhibitory.
Souhrn
Moderní medicína aktuálně prožívá jakýsi věk mikrobiomu a zprávy zahrnující preklinické a klinické studie o úloze střevní mikroflóry ve vztahu k nádorovým onemocněním přinesly pozitivní poznatky a data o možnostech modifikovat složení mikrobiomu ve prospěch onkologického pacienta. Získali jsme jistý náhled na vliv mikrobiomu na imunitní sytém a konsekventně i genezi onkologických onemocnění. Stále však zůstává mnoho tajemství v poznání mechanismů, kterými střevní mikroflóra a imunitní systém komunikují. Výsledkem této snahy je docílit optimální strategie modulace střevního mikrobiomu za účelem zvýšení léčebných odpovědí na moderní imunoterapii onkologických onemocnění.
Závěry
- Pokud je to možné, vyhnout se antibiotikům před užíváním a během užívání imunoterapie checkpoint inhibitorem, což může zlepšit odpověď na terapii.
- Kompozice mikrobiomu může být prediktorem odpovědi na imunoterapii, což umožňuje cílenou modulaci mikrobiomu již před zahájením imunoterapie.
- Klinické studie testující přínos modulace mikrobiomu pacientů s nádorovým onemocněním, kteří dostávají checkpoint inhibitory, již probíhají.
Autoři:
MUDr. Jan Špaček, MUDr. Michal Vočka, MUDr. Stanislav Hloušek, MUDr. Ludmila Křížová, prof. MUDr. Lubomír Petruželka, CSc.
Onkologická klinika 1. LF UK a VFN v Praze
